本文综述了近五年来合成生物学在微生物药物研究领域的技术革新,及其在氨基糖苷类抗生素、核苷类抗生素、核糖体肽、萜类以及聚酮类化合物等5大类微生物天然药物的发掘、生物合成以及新结构创制等方面的应用。 前言 人类使用天然产物作为药物来预防、治疗疾病已有上千年历史。天然产物来源非常丰富,其中,微生物来源天然产物是目前开发临床抗菌、抗肿瘤、免疫抑制剂等药物的重要资源,其在农业、食品、军事等领域也有广泛的应用。统计数据显示,2000年以后上市的22种抗菌药物中,有12种来自于微生物次级代谢产物;而世界药物市场上约70%的抗生素产品来自于微生物,其中2/3是由放线菌产生。此外,抗感染药物青霉素、降胆固醇药物洛伐他汀、抗真菌药物棘白霉素和灰黄霉素,以及免疫抑制剂环孢霉素等临床一线药物均来源于真菌,充分显示了微生物来源天然产物在药物研发领域的重要地位。 自青霉素和链霉素相继被发现后,20世纪50年代至60年代进入到天然产物发现的“黄金期”。然而,从20世纪90 年代末期开始,传统的基于生物活性的天然药物筛选方法导致了大量已知化合物的重复分离,结构新颖的活性化合物的发现进程逐渐放缓,如何有效地靶向分离或者人工创造新型天然药物已成为微生物天然产物领域的研究热点。2015年,诺贝尔生理学或医学奖颁给了天然药物青蒿素的发现者中国药学家屠呦呦以及阿维菌素发现者日本科学家大村智、美国科学家坎贝尔,正式标志着天然产物发掘进入到“新黄金期”。 目前,微生物药物的研究面临两大挑战:一是超过99%的已知微生物难以在实验室培养,即使能被成功培养,大多数微生物都存在生长速度缓慢、在实验室条件下编码天然产物的基因不表达等问题;二是天然产物生物合成水平较低,野生型菌株的次级代谢产物合成水平通常在mg/L水平或更低,造成了活性天然产物分离鉴定和活性测定的困难。因此,天然产物生物合成基因簇(BGCs)的体外拼接、异源表达以及体内重组优化显得至关重要。然而,即使在分子生物学、代谢组学和系统生物学快速发展的今天,对BGCs进行以上操作也绝非易事。被称为“第三次生物技术革命”的合成生物学的兴起则大大改变了这一进程。合成生物学是在现代生物学和化学、分子和细胞生物学、进化系统学、数学、物理学、计算机和工程学、信息学等多科学基础上系统深度交叉融合发展而来,强调的是系统化设计和工程化构建,利用生物系统最基本的DNA、RNA和蛋白质等作为设计元件,再利用转录调控、代谢调控等生物功能把这些基本元件组装起来,形成生物模块,最后将这些生物模块连接成系统,从而获得重构或者非天然的“生物系统”,使生物体按照预期的方式实现各项生物学功能。近20年来,合成生物学已在生物能源、生物材料、医疗技术以及探索生命规律等诸多领域取得了令人瞩目的成就。本文作者将重点介绍合成生物学在推动微生物药物发展中的优势,并聚焦我国科研工作者近年来运用各种合成生物学技术在该领域取得的研究进展。 1 合成生物学技术为微生物药物发展创造新机遇 截至2020年3月,根据在线基因数据库“GOLD”公布的数据,已有3691种古细菌、328 612种细菌和32 233种真核生物完成基因组测序工作。进一步的生物信息学分析显示,许多微生物基因组所编码的合成次级代谢产物的潜在基因簇数量远远超过目前已鉴定的天然产物数,表明微生物天然产物“暗物质”是一个亟待开发的巨大宝藏,而合成生物学技术的迅猛发展为挖掘新型天然产物以及创制新型人工产物提供了前所未有的机遇。一方面,天然产物挖掘的研究策略日趋多样化,除了经典的以酶功能分析为主线的基因组挖掘外,伴随着合成生物学兴起的生物信息学和基因编辑技术,使得大量沉默基因簇得以有效挖掘和激活,新型天然产物的鉴定数量成爆发式增长,极大拓展了新天然产物的发现空间。另一方面,以基因元件(启动子、转录调控区域、核糖体结合位点、开放阅读框、终止子等)工程化为理念的合成生物学技术,可以用来设计与重构已有天然产物的生物合成途径,构建和利用通用型底盘细胞工厂,从而实现对已知化合物骨架的定向改造,创造新型人工产物。下面分别从3个技术层面综述合成生物学在微生物药物挖掘方面的优势。 1.1 生物信息学分析 目前,已知的大多数微生物天然产物是通过传统的基于生物活性筛选的分离方式得到的,这也导致了大量已知化合物的重复分离。为了解决这一问题,一方面可通过高通量组学分析(基因组学、转录组学、蛋白质组学和代谢组学),挖掘可能的沉默基因簇;另一方面可基于庞大的数据库,设计代谢通路和生物合成途径,高效异源表达天然产物。 在挖掘沉默基因簇方面,通用的挖掘平台antiSMASH只是对单个基因组进行分析,而且依赖于参照数据库的功能注释。为了对不同基因组之间的基因簇之间进行比较和进化分析,BiG-SCAPE则提供了对大量基因簇序列的相似性聚类分析(biosynthetic gene similarity clustering),结合基因簇的相似性网络结构和进化关系进行特征挖掘和多样性比较。但是,以上传统分析方法并没有充分发挥当前数据挖掘技术的优势,尤其是基于神经网络的深度学习技术在大数据中的巨大潜力亟待开发。随着人工智能(AI)技术的快速发展,越来越多的生物信息学工具与机器学习结合,极大地加强了沉默基因簇挖掘的深度,如Tietz等结合隐马尔可夫模型分析、启发式打分和机器学习开发了一个新型基因组挖掘工具RODEO,成功从已知基因组数据库中挖掘到超过1300种新型核糖体肽化合物(RiPPs),对其中6种进行鉴定,发现1种含有类似手铐的拓扑结构、1种含有罕见的瓜氨酸修饰,该工具的成功开发为“暗物质”的挖掘提供了一个可借鉴的框架。 在构造天然产物人工合成通路和适配性底盘细胞方面,众多数据库平台和新型工具的开发使合成生物学设计更加理性和高效,如胡黔楠课题组建立起来的RxnFinder平台,集天然产物骨架查找、未知酶反应预测、生物合成途径设计、细胞途径优化等功能于一体,是将合成生物学理念应用到微生物药物开发领域的强大工具。另外,机器学习也逐渐应用在合成代谢系统的改造和设计上,并取得了不错的成果。2019年赵惠民课题组利用集成机器人系统BioAutomata与机器学习算法相结合,使基于生物系统的“设计-构建-测试-学习”流程实现完全自动化,并已通过优化的番茄红素生物合成途径验证了其功能。因此,充分利用现有的组学大数据,开发、拓展、融合其他领域机器学习和数据挖掘的技术,可以实现微生物天然产物的高效自动化挖掘,并为搭建高附加值化合物人工合成途径提供可行方案。 1.2 基因编辑和重组技术 传统的细菌基因工程很大程度上依赖于基于载体质粒的单交换或双交换,这对于获得目标工程菌株而言费时费力。此外,突变株筛选标记的选择与使用也会带来不少麻烦。为了克服传统基因重组技术的局限性,科学家们先后利用了包括Cre/loxP、Dre/rox和Flp/FRT在内的位点特异性重组策略来构建基因工程菌株。然而,这些方法都会保留染色体上的重组酶识别位点,因此会限制后续多次遗传操作的应用。近年来,CRISPR-Cas9基因编辑系统快速发展,在以链霉菌为代表的微生物基因工程操作中大显身手。CRISPR-Cas9的基本原理是,Cas9内切酶首先与向导RNA(gRNA)形成复合物,并被引导到一个与gRNA的间隔序列互补的DNA序列上,Cas9随即诱导基因组DNA双链断裂(DSB),然后通过非同源末端连接修复(NHEJ)或同源定向修复(HDR)机制修复DSB,从而实现基因敲除、转录抑制和激活等基因操作。CRISPR-Cas9系统优于上述同源重组或位点特异性重组系统,因为它省时省力,不需要选择标记,也不会在基因组上留下遗传标记。2015年,Cobb等开发了一个工程化的CRISPR-Cas系统pCRISPomyces,用于链霉菌菌株的快速多重基因组编辑,在多种链霉菌中实现了20 bp~30 kb不等的基因缺失,效率达到70%以上,证明该系统可进一步发展成为细菌基因组编辑的一个强大工具。2017年,Zhang等利用CRISPR-Cas9系统,以相对较小的基因组扰动策略在基因组中插入启动子,激活了多个链霉菌菌种中不同类型的沉默基因簇,包括Ⅰ型、Ⅱ型和Ⅲ型PKS、NRPS、杂合PKS-NRPS和膦酸酯簇,获得多个新型天然产物,为新型微生物天然产物的挖掘提供了更为高效的思路和工具。 除基因编辑外,基因组装配重组技术也是合成生物学发展的前沿领域,目前Red/ET重组技术、酵母细胞内同源重组和Gibson一步拼接已发展成为3种成熟的基因簇组装技术,使得我们可以高效地挖掘和生产天然产物,如2016年山东大学张友明团队将Rec/ET系统和Redαβ系统整合到同一个宿主中,通过克隆载体和修饰元件的标准化,实现了生物合成途径克隆、转移和异源表达的无缝对接。 1.3 底盘细胞的工程化改造 传统的微生物药物开发,是通过微生物经大规模发酵培养和分离提取来完成的,但是许多能产生有价值的活性化合物的天然菌株存在难以培养、生长速率慢、产量低等缺点,限制了工业化生产。随着DNA组装技术的快速发展和应用,在充分认识微生物药物合成途径的前提下,基于合成生物学原理,可以通过设计和改造优势微生物菌株成为异源高产的底盘细胞,用于更多活性天然产物的生产。一方面,可以通过在底盘细胞中重构目标化合物的生物合成途径,来激活在原宿主中沉默的生物合成基因簇;另一方面,在合成生物学的指导下,对生物原件进行重新设计、集成和装配,在底盘细胞中让新引入的代谢途径与宿主原有的代谢路径进行适配,组成全新的代谢网络,从而为目标产物的合成提供充足的前体供应,最终实现结构新颖、种类丰富的“非天然”天然产物甚至是人工药物的定向合成。 为了高效生产微生物天然产物,利用合成生物学理念对底盘细胞进行工程化改造的策略通常有3种。第一,基因组精简和优化。采用较小基因组作为底盘细胞进行异源表达,可减少其他不必要的本底路径对底物、能量、还原力的消耗,并降低异源化合物的检测和纯化难度,提高目标产物产量。例如,2019年李永泉课题组等分别敲除了纳他霉素的产生菌Streptomyces chattanoogensis L10中1.3 Mb和0.7 Mb的非必需基因,得到两个底盘细胞L320和L321,用以高效表达聚酮天然产物。第二,对各类调控因子进行改造。微生物底盘细胞复杂的生长分化过程以及与之相关的初级和次级代谢网络,伴随着多种调控因子的调控,其中既有全局性调控因子,也有只参与某个特定产物合成的途径专一性调控因子。把这些调控因子进行精确的改造,如敲除、替换和点突变等,可使原有的生物合成基因簇沉默,消除本底代谢产物的影响,从而提高目标化合物产量。例如,2018年Kallifidas等通过过表达Streptomyces albus J1074中的转录调控因子CRP,以及敲除pfk基因等遗传改造,成功实现了放线紫红素的异源表达。第三,增加前体物供应。天然产物异源表达失败或产量较低可能是由于宿主内缺乏所需底物的合成途径,要想提高产量,可以通过合成生物学工程化改造的方法改变宿主的代谢途径以适应异源表达的需求。例如,2019年罗小舟等以酿酒酵母为底盘,通过对底物GPP合成途径优化以及引入新的大麻素合成酶等工程化改造,成功异源表达了大麻素及其类似物。这一合成生物学领域的突破性进展为大麻素的大规模发酵生产奠定了基础,也为其他高附加值天然药物的异源表达提供了重要的借鉴。 2 合成生物学在微生物药物研究中的应用 天然产物一直是药物先导化合物的重要来源,但20世纪80年代兴起的组合化学和高通量筛选技术,使传统药物发现受到冷落,许多大型制药公司大幅裁减了基于天然产物药物挖掘的项目,主要原因有两个:一是传统技术与方法发现的天然产物骨架有限;二是天然产物在鉴定、纯化、合成和规模化生产等方面存在重大技术挑战。进入21世纪,高通量基因组测序技术的迅速发展及分子生物学操作技术的日趋成熟为开发新的天然产物发掘方法创造了条件,特别是合成生物学概念与相关技术的快速崛起,使科学家们可以高通量分析、预测未知化合物的骨架结构,也可以设计和改造合适的底盘细胞,从而提高已知化合物的产量以及获得更多结构修饰的新化合物。这一理念先后在大环内酯类抗生素和抗疟化合物青蒿素的开发中获得成功,并在更多微生物天然药物研究中大放异彩。 2.1 氨基糖苷类抗生素 作为曾经治疗细菌感染的一线临床药物,氨基糖苷类抗生素在人类与病原微生物的抗争中作出了巨大贡献。虽然这一大类药物一直以来因其耳毒性和肾毒性等毒副作用而颇受诟病,并且因其日益严重的耐药性而受到严峻挑战,但借助合成生物学能使这些经典“老药”焕发新的活力。 庆大霉素是氨基糖苷类代表性化合物,临床上曾经是治疗由革兰氏阴性菌所引发严重感染的首选药物。庆大霉素骨架上复杂多样的甲基化和氨基化修饰与其生物活性密切相关,也是其耐药性产生的关键结构单元。孙宇辉课题组从单基因功能的探究到多基因网络的解析,全面揭示了庆大霉素甲基化立体交叉代谢网络,为庆大霉素复杂多组分的产生提供了合理的解释,更重要的是为定向产生高效低毒的庆大霉素单组分提供了一张清晰的代谢线路图。西索米星是庆大霉素的结构类似物,但性能上大大优于后者,孙宇辉课题组近来开发了一种将CRISPR-Cas9系统与体外λ包装系统相结合的克隆方法,成功用于西索米星合成基因簇的靶向克隆(40.7 kb),为后续西索米星的开发奠定了基础。这种基因簇克隆的新颖方法普适性好,有望广泛应用于微生物天然产物途径的高效克隆。 C7N氨基环醇β-valienamine和valienamine是用于开发新型生物活性β-糖苷酶抑制剂的平台化合物, 由于结构中存在多手性中心,对其进行化学全合成非常困难。冯雁课题组和白林泉课题组利用来自圆形芽孢杆菌(Bacillus circulans)的具有立体选择特异性的异源氨基转移酶BtrR,设计了β-valienamine的人工合成途径并实现了在井冈霉素产生菌吸水链霉菌5008(Streptomyces hygroscopicus5008)衍生菌株中的生产。接着,他们运用蛋白质进化技术,将来自大肠杆菌的BtrR同工酶WecE改造成活性提高了32.6倍的突变体酶蛋白VarB,并将两个拷贝的varB基因引入吸水链霉菌5008衍生菌株,实现了一步法发酵产生valienamine (图1)。这项工作通过合成生物学的理念建立了快速生产β-valienamine和valienamine的途径,大大简化了常规生产时所涉及的有效霉素A合成和降解的多个生物合成步骤。
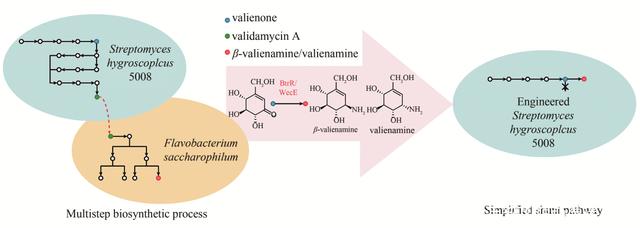
图1 Valienamine天然多步合成途径及改造后的简化合成途径
α-葡萄糖苷酶抑制剂阿卡波糖是由放线菌Actinoplanes sp. SE50/110产生的治疗2型糖尿病的主要药物。阿卡波糖的生物合成途径一直未被清晰揭示,严重阻碍了在产生菌中提升其发酵效价。近日,白林泉课题组发现化合物1-epi-valienol和valienol是阿卡波糖合成途径的旁支产物,并在发酵液中大量累积,这是由于氨基脱氧己糖单元合成不充分造成的。在此基础上,该课题组改造了阿卡波糖的代谢通路,减少旁支产物的同时,提高了氨基脱氧己糖这一前体物的合成量,最终将阿卡波糖的产量提升至7.4g/L。这项工作也证明,利用合成生物学的理念和手段,可以将已有的合成途径进行理性改造,从而大幅提高天然药物效价。 2.2 核苷类抗生素 核苷类化合物结构独特,临床上许多用于治疗病毒感染性疾病的药物以及农业上用于生物防治植物病虫害的抗生素都来自于这个家族。核苷类抗生素的生物合成逻辑并不复杂,一般是通过简单的碱基模块构建复杂的分子,但合成过程涉及许多复杂的多酶反应。近年来,核苷类抗生素生物合成领域取得了多项突破,为通过合成生物学针对性地制造人工设计的核苷类药物铺平了道路。陈文青课题组发现并解析了多氧霉素(polyoxin)中氨甲酰基聚草氨酸(carbamoyl poly-oxamic acid, CPOAA)的生物合成途径,并体外重构了CPOAA的生物合成途径,丰富了核苷类抗生素可编辑的合成元件。同时,他们解析了多氧霉素核苷骨架C-5特殊的甲基化修饰和喷司他丁(pentostatin, PTN)以及维达拉滨(vidarabine, Ara-A)C-2羟基的异构化,为核苷类抗生素的体外改造提供了参考。他们还解析了间型甲霉素(formycin A, FOR-A)和吡唑呋啉(pyrazofurin A, PRF-A)等嘌呤相关的C-核苷类抗生素核糖与吡唑衍生物的碱基C-糖苷键的催化基础,以及结核菌素(tubercidin, TBN)等核苷类似物嘌呤与糖苷的N-糖苷键连接途径。这些核苷类抗生素的组装逻辑的阐明不仅为进一步了解相关核苷类抗生素的生物合成提供了酶学基础,而且有助于通过合成生物学策略合理设计更多的杂合核苷类抗生素。最近,他们报道了一种靶向基因组挖掘方法,寻找并表征了海口小单孢菌DSM 45626和柠檬色链霉菌NBRC 13005中嘌呤核苷类抗生素芒霉素(aristeromycin, ARM)和助间型甲霉素(coformycin, COF)的生物合成途径,为合理寻找嘌呤类抗生素开辟了新的途径(图2)。
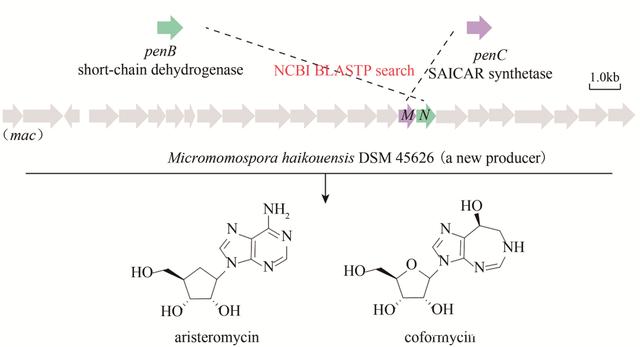
图2 嘌呤核苷类抗生素的靶向基因组挖掘
以上研究结果阐明了多个核苷类抗生素的生物合成途径以及组装逻辑,丰富了该家族可编辑的合成元件,并找到多处核苷类抗生素可修饰位点,有助于将来通过合成生物学策略定向设计多修饰位点的杂合核苷类抗生素。 2.3 核糖体肽 核糖体肽是一大类具有高度结构多样性和多种生物活性的天然产物。到目前为止,已经发现了20多个不同的核糖体肽家族,每个家族都具有独特的化学特征。硫肽类抗生素是一类富含元素硫、结构被高度修饰的核糖体肽,具有包括抗感染、抗肿瘤和免疫抑制等在内的一系列重要生物活性。因此,对硫肽类的生物合成研究有助于理解肽或蛋白质的复杂翻译后修饰过程,并能指导开发新的肽类药物。那西肽(nosiheptide)是最早被解析生物合成途径的核糖体肽之一,近年来,刘文课题组解析了一类自由基S-腺苷甲硫氨酸(SAM)甲基转移酶NosN的功能, 该酶除了催化甲基转移,还可以通过功能化S偶联的吲哚部分以选择性地构建一碳单元,与硫肽骨架形成酯键并建立nosiheptide特有的侧环系统,来转化聚噻唑基肽中间体。同时,刘文课题组还解析了硫肽类抗生素的中央哌啶杂环的生物合成,这一成果极大地丰富了核糖体肽的合成和修饰元件。硫链丝菌素(thiostrepton,TSR)和盐屋霉素(siomycin,SIO)也都是硫肽抗生素重要代表,可有效拮抗多种革兰氏阳性细菌,并已被用作动物抗菌剂使用。基于TSR与原核病原体的构效关系,刘文课题组构建了一个新型硫肽化合物组合合成平台,得到了经喹啉酸(quinaldic acid,QA)修饰的SIO类似物,并生成了一个新的SIO衍生物5'-氟-SIO,其水溶性相比天然硫肽化合物有很大改善,且抗菌活性超过TSR,这为利用合成生物学策略改造现有核糖体肽的理化性质提供了新思路(图3)。
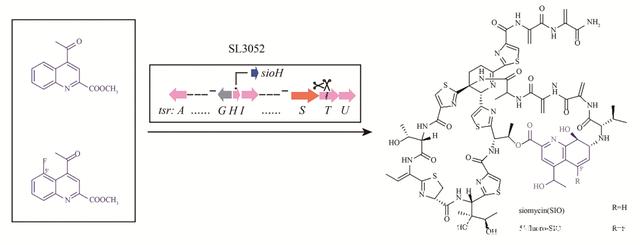
图3 喹啉酸及其类似物喂养工程菌SL3052产生siomycin及其类似物
除了硫肽类化合物,其他核糖体肽家族化合物的研究也正如火如荼地进行。张琪课题组以cypemycin为模型,分析了前体肽成熟所涉及的构效关系,生成了一系列新的cypemycin突变体,其中T2S突变体表现出对微球菌的活性增强。这项研究凸显了运用基因组挖掘和合成生物学技术探索核糖体肽的潜力。 2.4 萜类 萜类是自然界中最为丰富的一类化合物,在生物医药、能源、食品和化妆品领域有着广泛应用,著名的青蒿素和紫杉醇都属于这一大家族。时至今日,研究人员对萜类化合物生物合成元件的挖掘还远远不足。为此,刘天罡课题组对丝状真菌来源的Ⅰ型萜类环化酶进行系统发育分析,发现第三个进化分支(Clade Ⅲ)上的萜类环化酶具有底物及反应杂泛性的潜质。随后,该课题组在前期对萜类化合物“定向合成代谢”深刻认识的基础上,构建了一个含有3个不同模块(底物供给模块、不同异戊二烯前体合成模块、萜类合酶模块)的萜类化合物组合生物合成平台,研究两个位于Clade Ⅲ分支的萜类环化酶FgMS和FgGS合成萜类化合物的潜力。结果显示,它们能够合成多达50种单萜、倍半萜、二萜以及二倍半萜化合物,其中包含3个全新骨架,从而证明了上述萜组合生物合成平台的有效性与高效性。维生素E是全球市场容量最大的维生素类产品之一,其化学结构中含有萜结构单元,一直以来,工业上依靠化学法对其进行合成。刘天罡课题组与能特科技公司合作,采用微生物发酵合成的法尼烯为中间体来合成维生素E前体——异植物醇, 进而合成维生素E,颠覆了国外垄断数十年的化学全合成技术,为萜类药物的生物合成提供了新思路。 酿酒酵母是天然化合物生产的优质异源宿主,然而,它对亲脂性天然产物,特别是在细胞内积累的化合物,例如聚酮化合物和类胡萝卜素,显示出有限的产量。刘天罡课题组将谷氨酸镰刀菌中的倍半萜烯合酶FgJ03939在酿酒酵母底盘中得到充分利用,以生产新型倍半萜品镰刀菌二烯、表-岩藻糖醇、岩藻糖醇和5/7、5/6/3三环系统以及5个已知的倍半萜,这极大丰富了萜类化合物可编辑的合成元件(图4)。赵广荣课题组重建了正交柠檬烯生物合成(orthogonal limonene biosynthetic, OLB)途径,该途径引入NPP合成酶编码基因SlNDPS1,从而实现了将IPP和DMAPP转化为NPP(cis-GPP),再由植物来源的柠檬烯合成酶催化NPP转化为柠檬烯。结果显示,正交柠檬烯生物合成途径能比传统柠檬烯生物合成途径更加有效地生产柠檬烯,当感应葡萄糖的启动子HXT1(PHXT1)在染色体水平调控竞争基因ERG20的表达时,携带正交柠檬烯生物合成途径的菌株在补料分批发酵中可产生917.7 mg/L的柠檬烯,比传统柠檬烯生物合成途径增加6倍,是目前报道的最高产量。在酿酒酵母生成萜类化合物研究中,正交工程策略正展现出巨大的潜力。
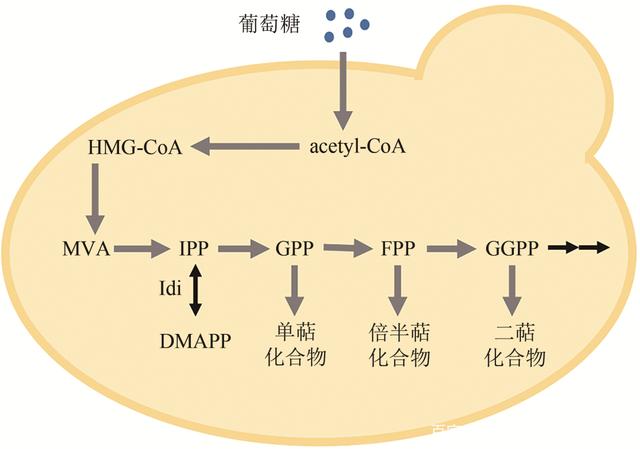
图4 酿酒酵母中萜类化合物合成通路
目前,利用合成生物学构建的人工合成体系通常不具备天然催化体系中酶的高度组织性,由此会大大降低整体的催化效率,并会导致代谢流不平衡。为解决这一难题,刘天罡课题组和夏江课题组开发了一种人工蛋白骨架结构,该结构基于一对简单的多肽相互作用标签RIAD和RIDD,RIDD会自发形成生理条件稳定的二聚体,RIAD则会进一步与RIDD二聚体结合,形成稳定的三聚结构,通过在目的蛋白上分别融合表达这一对多肽标签,就能实现原本存在物理分割的代谢通路的链接,使人工合成体系运转得更为高效。作者将这一技术运用到萜类化合物虾青素和类胡萝卜素的生物合成中,在底盘细胞中对萜类合成前体的代谢关键节点进行了精准组装进而汇聚代谢流,成功实现了高产。这项工作证实,通过人工蛋白骨架结构可以将目标化合物的关键合成节点进行连接,从而解决底物传递以及代谢流不平衡等问题,最终实现目标分子产量的提升。毫无疑问,人工蛋白骨架技术是未来合成生物学的一大热点,将在更多更为复杂的生物体系中得到应用。 2.5 聚酮化合物 阿维菌素等具有重要药用价值的聚酮化合物是放线菌的次级代谢产物,主要在发酵罐中菌体生长的稳定期产生,而聚酮化合物生物合成的细胞内代谢物源头一直未有定论。近来,王为善课题组、张立新课题组和向文胜课题组联手,通过控制细胞内三酰甘油(TAG)的代谢流大幅提高了链霉菌多聚酮的效价。研究人员首先运用多组学技术发现,在菌体的初级代谢中,胞内积累的TAG在稳定期会降解,这一过程将导致碳代谢从胞内TAG和胞外底物的合成流向聚酮化合物的生物合成。基于这一发现,研究人员设计了一种名为“TAG的动态降解”(ddTAG)的策略,提高了天蓝色链霉菌、委内瑞拉链霉菌、缘条链霉菌和阿维链霉菌中放线菌素、杰多霉素B、土霉素和阿维菌素B1a的滴度,尤其将ddTAG应用到180 t工业规模发酵中,可将阿维菌素B1a的效价提高到9.31 g/L,这也是迄今为止阿维菌素的最高发酵效价。 另一个通过改变前体供应代谢流来提高聚酮类药物发酵产量的例子是红霉素。红霉素的生物合成通常是以丙酰辅酶A为直接前体,但丙酰辅酶A的过量供应会导致高丙酰化引起的反馈抑制,从而影响红霉素的发酵。为解决这一问题,叶邦策课题组开发了一种能解除丙酰基转移酶引起的反馈抑制来提高细胞中丙酰辅酶A供应的策略,结果显示,基因工程菌株中红霉素产量比工业高产菌株Ab高出22%。这项发现揭示了蛋白质酰化在抗生素合成前体供应中的作用,并为应用合成生物学提升次级代谢产物产量提供了有效的翻译后修饰策略(PTM-ME)。 3 微生物药物合成生物学面临的挑战与展望 进入21世纪以来,高通量测序技术的飞速发展已经产生了海量微生物基因组数据,初步的生物信息学分析显示,微生物基因组理论上编码的次级代谢产物数量远远大于从这些微生物中已分离得到的化合物,暗示已知天然产物相对于大自然“暗物质”化合物库而言仅仅是冰山一角。虽然以antiSMASH、BiG-SCAPE等为代表的“基因组扫描” 技术的应用已经成功挖掘出许多新型天然产物,但是,这些分析工具需要借助已知生物合成途径作参考,且往往依赖于研究人员的经验判断,无法捕获基因组信息与合成产物之间的高阶信息,从而限制了其发现新化合物合成途径的能力。因此,更加先进智能的天然产物合成途径预测工具,尤其是基于已有生物合成途径的人工智能深度学习的大数据分析方法亟待开发和运用。 获得了可能编码天然产物的基因簇后,还需要置于合适的微生物细胞工厂中表达,以实现对潜在天然产物的结构表征和活性测试。然而,由于人类对生物体系的认知还十分有限,当前基于合成生物学设计的底盘细胞代谢途径并不能完全发挥预期的功能,还需要深入研究微生物初级代谢和次级代谢之间的关系和调控机制,为构建适合高产不同种类化合物的优质底盘细胞提供理论支撑。另外,由于目前庞大的基因组数据库已经超出了传统化合物挖掘的能力,利用机器学习技术,实现生物系统“设计-构建-测试-学习”流程完全自动化,可使我们避免浪费过多的时间在无谓的尝试上,提高微生物药物挖掘和生产的效率。 综上所述,我国近五年来在微生物药物合成生物学领域取得了多项突破性进展,但仍然与欧美顶尖合成生物学研究团队存在差距。随着病原菌耐药性的日益加重,以及新型疾病的不断出现[如2019年底爆发的2019冠状病毒病(COVID-19)等],我国生物药物产业的发展正面临着自主知识产权药物品种匮乏、品质提高和规模化生产等诸多方面的难题和机遇,而合成生物学则是促成我国生物药物产业超常规发展的核心动力。我们要继续在天然药物资源挖掘、合成基因元件库搭建、药物人工合成体系深度优化、高效基因编辑技术开发、酶蛋白结构生物学与分子进化等方向开展研究,并积极布局合成生物学前沿,包括生物传感器(biosensors)、基因组尺度的代谢网络模型(genome-scale metabolic models)、基于生物的化学地图(bio-based chemicals map)等,最终实质性加强基础研究与工业化生产的深入对接,系统整合各方实力,建立我国从上游到下游,从源头到产品的系统性和可持续的药物研发体系,彻底变革小分子药物的创制模式,实现我国生物医药产业的源头创新和转型升级。